Edición génica y CRISPR
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats ) o Repeticiones Palindrómicas Cortas Agrupadas y Regularmente Espaciadas se refiere a una tecnología de edición génica recientemente desarrollada que puede buscar, eliminar y reemplazar secuencias en el ADN de manera muy precisa.
Este proceso, cuya base fue descrita por primera vez por el equipo del Dr. Francis Mojica en 2005, supone una aportación nuclear a la Microbiología y la Biología en general, abriendo grandes perspectivas en el desarrollo de tecnologías de edición génica aplicables a todo tipo de organismos.
CRISPR es una herramienta dinámica y versátil que nos permite llegar a cualquier lugar en el genoma y una tecnología de base por la capacidad para actuar sobre el ADN de cualquier célula, tejido, órgano, sistema.
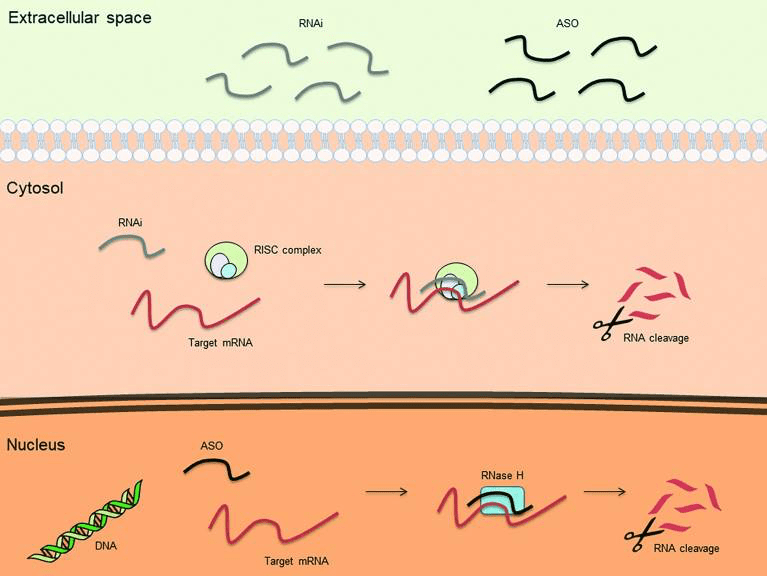
La herramienta utiliza la combinación de dos moléculas para editar el/los gen/genes relacionados con una enfermedad: una nucleasa (editor) y ARN guía (que indica a la nucleasa el lugar exacto para editar).
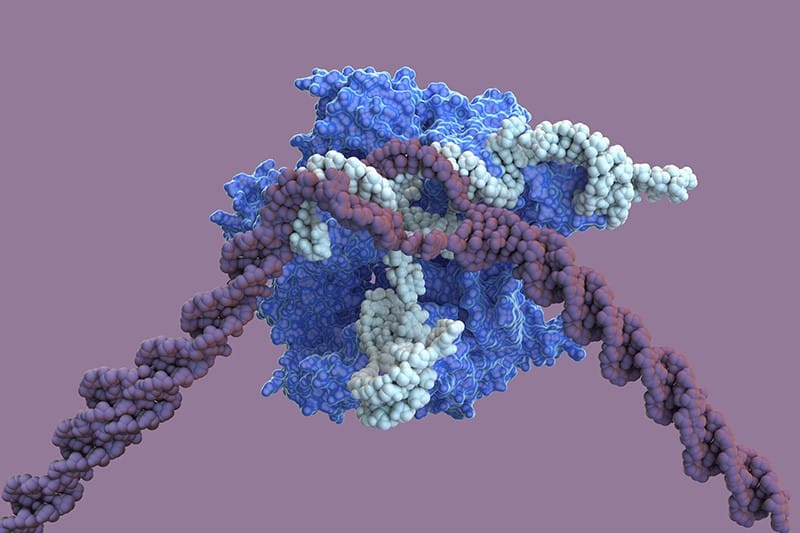
La clave de esta tecnología es la ESPECIFICIDAD, la capacidad para editar el ADN en el lugar preciso gracias a la combinación nucleasa - ARN guía.
Dado que la edición génica actúa directamente en el ADN, existen algunos riesgos que podrían alterar el fin terapéutico y provocar efectos secundarios adversos. Estos desafíos se están estudiando actualmente con el objetivo de que las terapias de edición génica de nueva generación sean precisas y seguras. Entre los riesgos más importantes podemos destacar:
- Modificaciones genéticas no intencionadas: al editar una secuencia de ADN, es posible que se produzcan modificaciones genéticas no intencionadas o reordenamientos cromosómicos, especialmente si se realizan varias ediciones al mismo tiempo.
- Eventos de edición fuera de objetivo: también existe el riesgo, dependiendo de las secuencias guía, de modificar las ubicaciones de ADN que no son el sitio objetivo deseado.
Esta tecnología puede acabar en futuro con las enfermedades de base genética y va a ser apoyado de manera activa por nuestra Fundación en los próximos años.
La Fundación esta trabajando para seleccionar un equipo de investigación para apoyar el desarrollo de esta terapia aplicado a la Leucodistrofia TUBB4A.