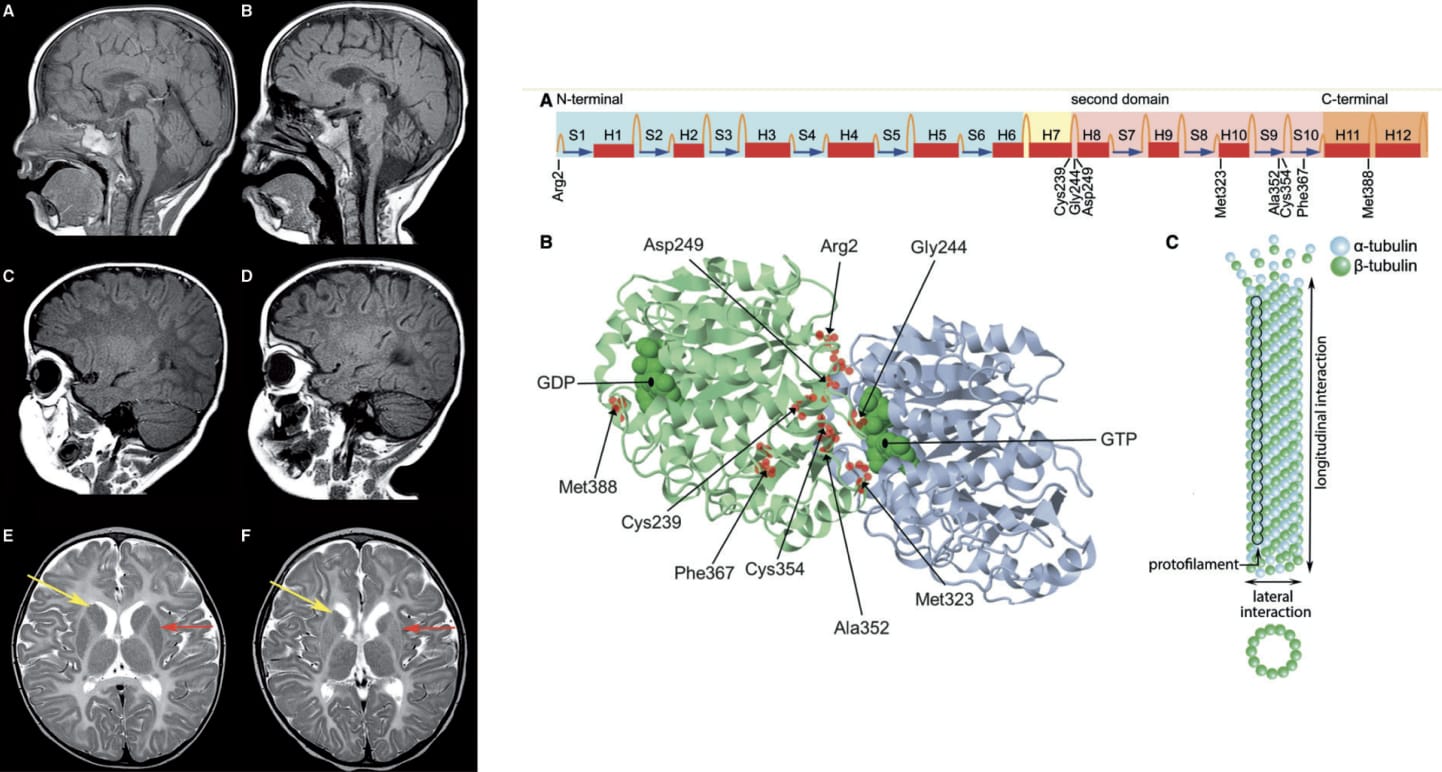
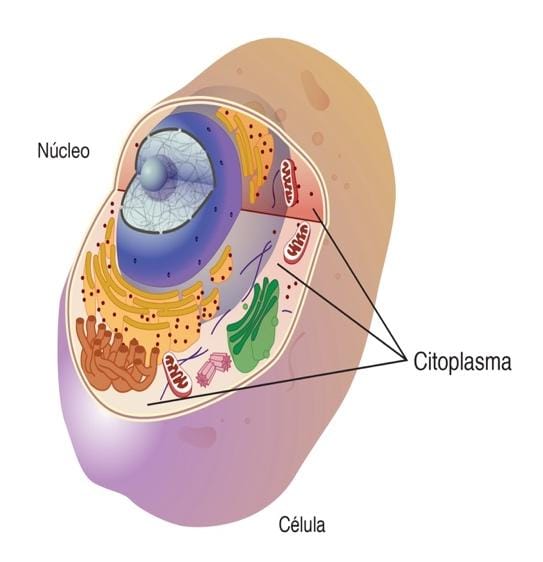
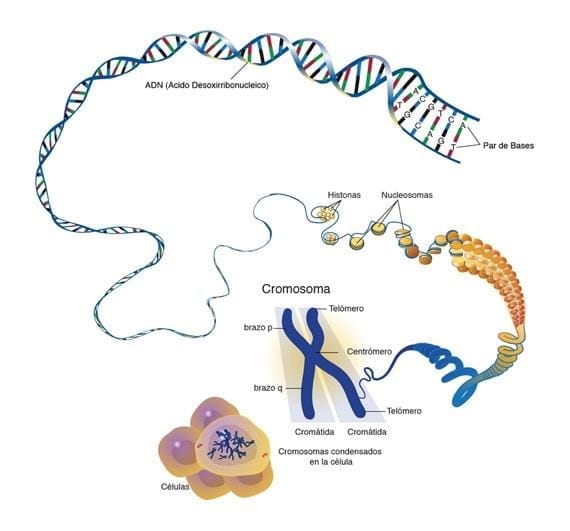
Sistema Nervioso Central
El sistema nervioso central (SNC) esta constituido por el cerebro y la médula espinal.
Este sistema combina la información y coordina la actividad del cuerpo humano.
El cerebro es el órgano más complejo del cuerpo humano utilizando el 20 por ciento del oxígeno total que inhalamos.
El cerebro tiene aproximadamente cien mil millones de neuronas, interconectadas entre si.
El cerebro está protegido por el cráneo; la médula espinal viaja desde la parte posterior del cerebro, por el centro de
la columna vertebral, deteniéndose en la región lumbar de la parte baja de la espalda.
Adicionalmente, cerebro y la médula espinal están protegidos por una membrana de triple capa llamada meninges.
La retina, nervio óptico, nervios olfativos y epitelio olfativo se pueden consideran parte del SNC junto con el cerebro
y la médula espinal puesto que se conectan directamente con el tejido cerebral sin fibras nerviosas intermedias.
El sistema nervioso central esta siendo estudiado sin solución de continuidad por la complejidad del mismo. Controla
pensamientos, movimientos, emociones y deseos. Controla temperatura corporal, liberación de hormonas, nuestra
respiración, frecuencia cardíaca, ...
Cerebro
El cerebro es el órgano más complejo del cuerpo humano. La corteza cerebral (la parte más externa del cerebro y la mayor
parte en volumen) contiene entre quince y treinta mil millones de neuronas, cada una de las cuales está conectada a su
vez con miles de neuronas.
En total, alrededor de cien mil millones de neuronas y mil millones de células gliales (de apoyo) conforman el cerebro
humano.
El cerebro utiliza alrededor del 20 por ciento de la energía total consumida por el cuerpo.
El cerebro es el módulo de control central del cuerpo y coordina la actividad. Del movimiento físico a la secreción de
hormonas, la creación de recuerdos y la sensación de emoción.
Para llevar a cabo estas funciones, algunas secciones del cerebro tienen un papel especifico. Sin embargo, muchas
funciones superiores (razonamiento, resolución de problemas, creatividad) implican diferentes áreas que trabajan de
manera conjunta.
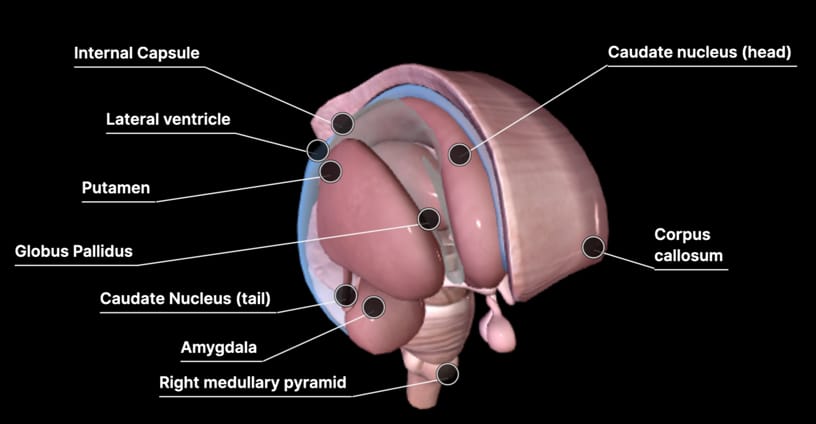
Regiones cerebrales
A continuación, veremos algunas regiones cerebrales específicas con un poco más de detalle:
-
Ganglios basales: involucrados en el control de los movimientos motorizados voluntarios, el aprendizaje procedimental y
las decisiones sobre qué actividades motoras llevar a cabo.
-
Cerebelo: principalmente involucrado en el control motor preciso, pero también en el lenguaje y la atención. Si el
cerebelo sufre degeneración o esta dañado, hay una interrupción del control motor evidente.
-
Área de Broca: esta pequeña área en el lado izquierdo del cerebro (a veces a la derecha en individuos zurdos) es
importante en el procesamiento del lenguaje. Cuando se daña, a un individuo le resulta difícil hablar, pero aún puede
entender el habla. La tartamudez a veces se asocia a con un área de Broca poco activa.
-
Corpus calloso: una amplia banda de fibras nerviosas que se unen a los hemisferios
izquierdo y derecho. Es la estructura de sustancia blanca más grande del cerebro y permite que los dos hemisferios se
comuniquen. P.e., los niños disléxicos tienen el corpus calloso más pequeño; personas ambidiestras y músicos suelen
tener más grande.
-
Médula oblongata: extendiéndose por debajo del cráneo, está involucrada en
funciones involuntarias como vómitos, respiración, estornudos y mantenimiento de la presión arterial correcta.
-
Hipotalamo: sentado justo encima del tronco encefálico y aproximadamente del
tamaño de una almendra, el hipotálamo secreta una serie de neuro hormonas e influye en el control de la temperatura
corporal, sed y hambre.
-
Talamo: posicionado en el centro del cerebro, el tálamo recibe entrada sensorial y
motora y la transmite al resto de la corteza cerebral. Está involucrado en la regulación de la conciencia, el sueño, la
conciencia y el estado de alerta.
-
Amígdala: dos núcleos en forma de almendra en lo profundo del lóbulo temporal.
Están involucrados en la toma de decisiones, la memoria y las respuestas emocionales; particularmente las emociones
negativas.
Médula espinal
La médula espinal transporta información del cerebro al resto del cuerpo.
La médula espinal, que recorre casi toda la longitud de la espalda, lleva información entre el cerebro y el cuerpo, pero
también realiza otras tareas.
Desde el tronco encefálico, donde la médula espinal se encuentra con el cerebro, 31 nervios espinales entran en la
médula.
A lo largo de su longitud, se conecta con los nervios del sistema nervioso periférico (SNP) que entran desde la piel,
los músculos y las articulaciones.
Los comandos motores del cerebro viajan desde la columna vertebral hasta los músculos y la información sensorial viaja
desde los tejidos sensoriales, como la piel, hacia la médula espinal y finalmente hasta el cerebro.
La médula espinal contiene circuitos que controlan ciertas respuestas reflexivas, como el movimiento involuntario que
podría hacer el brazo si un dedo tocara fuego.
Los circuitos dentro de la columna vertebral también pueden generar movimientos más complejos, como caminar. Incluso sin
la entrada del cerebro, los nervios espinales pueden coordinar todos los músculos necesarios para caminar.
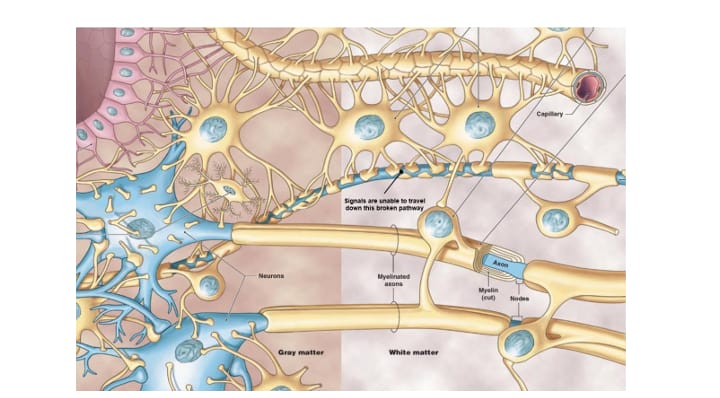
Sustancia blanca y gris
El SNC se puede dividir en sustancia blanca y gris. Como regla muy general, el cerebro consiste en una corteza externa
de sustancia gris y un área interna que alberga espacios de sustancia blanca.
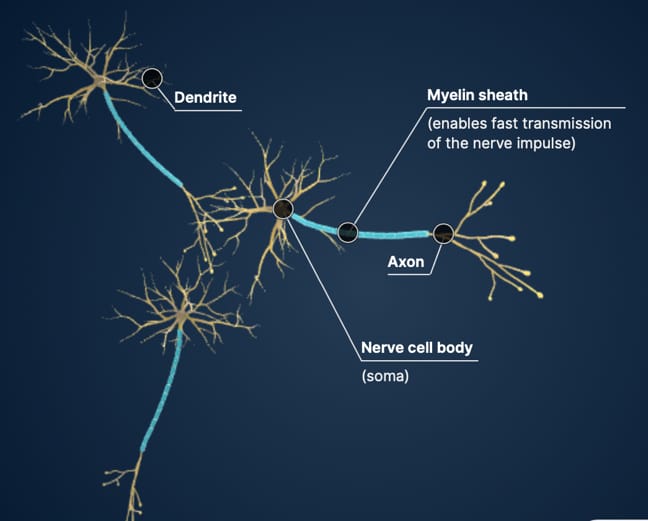
Ambos tipos de tejido contienen células gliales, que protegen y dan soporte a las neuronas. La sustancia blanca consiste
principalmente en axones (proyecciones nerviosa) y oligodendrocitos, un tipo de célula glial, mientras que la sustancia
gris esta compuesta, principalmente, por cuerpos neuronales (soma).
Células gliales centrales
También llamadas neuroglia, las células gliales a menudo se llaman células de soporte para las neuronas y se encuentran
en una proporción de 10 a 1.
Sin células gliales, los nervios en desarrollo a menudo pierden su camino y luchan por formar sinapsis funcionales.
Las células gliales se encuentran tanto en el SNC como en el SNP, pero cada sistema tiene diferentes tipos.
Concretamente, en el SNC tenemos:
-
Astrocitos: estas células tienen numerosas proyecciones y anclan neuronas a su suministro de sangre. También regulan el
medio ambiente local eliminando el exceso de iones y reciclando neurotransmisores.
-
Oligodendrocitos: responsables de crear la vaina de mielina: esta fina capa recubre los axones de las neuronas,
permitiéndoles enviar señales de manera rápida y eficiente.
-
Células ependimarias: recubren la médula espinal y los ventrículos del cerebro (espacios llenos de líquido), estas crean
y secretan líquido cefalorraquídeo (LCR) y lo mantienen circulando usando sus cilios en forma de látigo.
-
Gial radial: actúa como andamio para nuevas células nerviosas durante la creación del sistema nervioso del embrión.
Nervios craneales
Los nervios craneales son 12 pares de nervios que surgen directamente del cerebro y pasan a través de agujeros en el
cráneo en lugar de viajar a lo largo de la médula espinal. Estos nervios recopilan y envían información entre el cerebro
y partes del cuerpo, principalmente el cuello y la cabeza.
De estos 12 pares, los nervios olfativo y óptico surgen del cerebro anterior y se consideran parte del sistema nervioso
central.
-
Nervios olfativos: transmiten información sobre los olores desde la sección superior de la cavidad nasal a los bulbos
olfativos en la base del cerebro.
-
Nervios ópticos: llevar información visual desde la retina hasta los núcleos visuales primarios del cerebro. Cada nervio
óptico consta de alrededor de dos millones de fibras nerviosas.
Diferencia entre SNC y SNP
El término sistema nervioso periférico (SNP) se refiere a cualquier parte del sistema nervioso que se encuentre fuera
del cerebro y la médula espinal. El SNC está separado del sistema nervioso periférico, aunque los dos sistemas están
interconectados.
Hay una serie de diferencias entre el SNC y el SNP; una diferencia es el tamaño de las células. Los axones nerviosos del
SNC, las proyecciones delgadas de las células nerviosas que transportan impulsos, son mucho más cortas. Los axones
nerviosos del SNP pueden tener hasta 1 metro de largo (por ejemplo, el nervio que activa el dedo gordo del pie),
mientras que, dentro del SNC, rara vez son más largos que unos pocos milímetros.
Otra diferencia importante entre el SNC y el SNP implica la regeneración (recrecimiento de células). Gran parte del SNP
tiene la capacidad de regenerarse; si se corta un nervio en el dedo, puede volver a crecer. Sin embargo, el SNC no tiene
esta capacidad.